O Prémio Nobel de Fisiologia ou Medicina de 2023 foi atribuído conjuntamente a Katalin Karikó e Drew Weissman pelas descobertas sobre modificações de bases de nucleosídeos que permitiram o desenvolvimento de vacinas de mRNA eficazes contra COVID-19
O Comité Nobel indicou que as descobertas dos dois cientistas foram fundamentais para o desenvolvimento de vacinas de mRNA eficazes contra a COVID-19, durante a pandemia que começou no início de 2020. Através de descobertas inovadoras, que mudaram fundamentalmente a nossa compreensão de como o mRNA interage com o nosso sistema imunitário, os cientistas contribuíram para o desenvolvimento de vacinas durante uma das maiores ameaças à saúde humana, nos tempos modernos.
Vacinas antes da pandemia
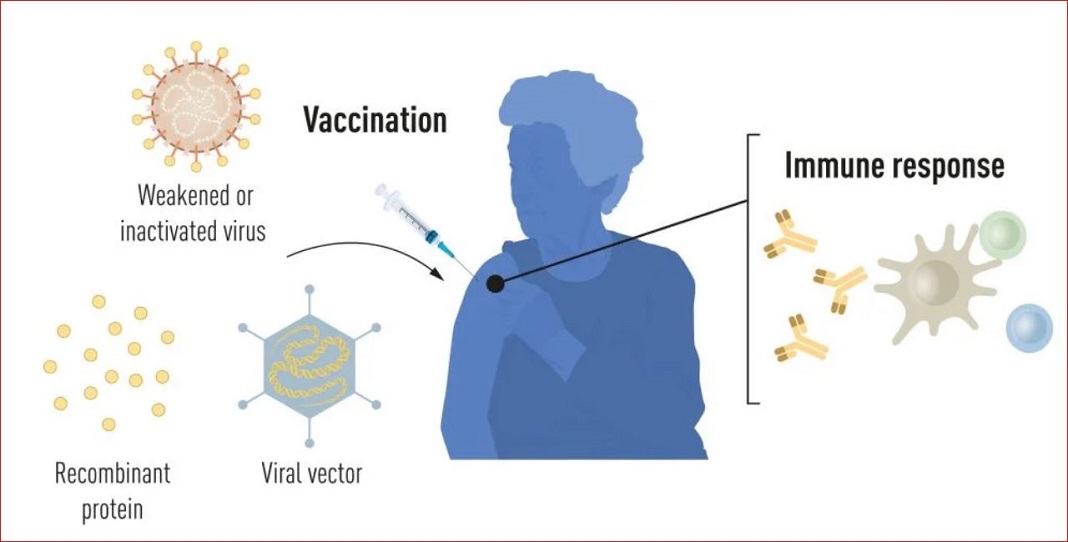
A vacina estimula a formação de uma resposta imune a um determinado patógeno. Isto dá ao corpo uma vantagem na luta contra doenças, no caso de uma exposição posterior. As vacinas baseadas em vírus mortos ou enfraquecidos estão disponíveis há muito tempo, como é o caso das vacinas contra a poliomielite, o sarampo e a febre-amarela. Já em 1951, Max Theiler recebeu o Prémio Nobel de Fisiologia ou Medicina pelo desenvolvimento da vacina contra a febre-amarela.
O progresso da biologia molecular nas últimas décadas permitiu o desenvolvimento das vacinas baseadas em componentes virais individuais, em vez de vírus inteiros. Partes do código genético viral, que geralmente codificam proteínas encontradas na superfície do vírus, são usadas para produzir proteínas que estimulam a formação de anticorpos bloqueadores do vírus. São exemplos as vacinas contra o vírus da hepatite B e o papilomavírus humano.
Alternativamente, partes do código genético viral podem ser movidas para um vírus portador inofensivo, um “vetor”. Este método é usado em vacinas contra o vírus Ebola. Quando as vacinas vetoriais são injetadas, a proteína viral selecionada é produzida nas nossas células, estimulando uma resposta imunitária contra o vírus alvo, descreve o Comité Nobel.
A produção de vacinas completas baseadas em vírus, proteínas e vetores requer cultura celular em larga escala. Um processo que exige muitos recursos limita as possibilidades de produção rápida de vacinas em resposta a surtos e pandemias. Portanto, os investigadores há muito que tentam desenvolver tecnologias de vacinas independentes da cultura celular, mas isto revelou-se um desafio.
Ilustração de métodos de produção de vacinas antes da pandemia de COVID-19.
Vacinas de mRNA: uma ideia promissora
Nas nossas células, a informação genética codificada no DNA é transferida para o RNA mensageiro (mRNA), que é usado como modelo para a produção de proteínas. Durante a década de 1980, foram introduzidos métodos eficientes para produção de mRNA sem cultura celular, chamados de transcrição in vitro. Este passo decisivo acelerou o desenvolvimento de aplicações da biologia molecular em diversos campos, esclareceu o Comité Nobel.
As ideias de utilização de tecnologias de mRNA para fins terapêuticos e de vacinas também decolaram, mas havia obstáculos pela frente. O mRNA transcrito in vitro foi considerado instável e difícil de entregar, exigindo o desenvolvimento de sofisticados sistemas lipídicos transportadores para encapsular o mRNA. Além disso, in vitro o mRNA produzido deu origem a reações inflamatórias. O entusiasmo pelo desenvolvimento da tecnologia de mRNA para fins clínicos foi, portanto, inicialmente limitado.
Esses obstáculos não desanimaram a bioquímica húngara Katalin Karikó, que se dedicou ao desenvolvimento de métodos para usar o mRNA na terapia. Durante o início da década de 1990, quando era professora assistente na Universidade da Pensilvânia, ela permaneceu fiel à sua visão de realizar o mRNA como terapêutico, apesar de encontrar dificuldades em convencer os financiadores da pesquisa sobre a importância do seu projeto. Um novo colega de Karikó em sua Universidade foi o imunologista Drew Weissman. Ele estava interessado em células dendríticas, que têm funções importantes na vigilância imunológica e na ativação de respostas imunes induzidas por vacinas. Estimulada por novas ideias, logo começou uma colaboração frutífera entre os dois, concentrando-se em como os diferentes tipos de RNA interagem com o sistema imunológico, descreu o Comité Nobel.
A descoberta
Katalin Karikó e Drew Weissman notaram que as células dendríticas reconhecem o mRNA transcrito in vitro como uma substância estranha, o que leva à sua ativação e à liberação de moléculas sinalizadoras inflamatórias. Eles se perguntaram por que o mRNA transcrito in vitro foi reconhecido como estranho, enquanto o mRNA de células de mamíferos não deu origem à mesma reação. Os cientistas perceberam que algumas propriedades críticas devem distinguir os diferentes tipos de mRNA.
O RNA contém quatro bases, abreviadas A, U, G e C, correspondendo a A, T, G e C no DNA, as letras do código genético. Os cientistas sabiam que as bases do RNA de células de mamíferos são frequentemente modificadas quimicamente, enquanto o mRNA transcrito in vitro não o é.
Katalin Karikó e Drew Weissman interrogaram-se se a ausência de bases alteradas no estudo in vitro o RNA transcrito poderia explicar a reação inflamatória indesejada. Para investigar isso, produziram diferentes variantes de mRNA, cada uma com alterações químicas únicas nas bases, que entregaram às células dendríticas. Os resultados foram surpreendentes: a resposta inflamatória foi quase abolida quando modificações de base foram incluídas no mRNA. Esta foi uma mudança de paradigma na nossa compreensão de como as células reconhecem e respondem a diferentes formas de mRNA. Os cientistas compreenderam imediatamente que a sua descoberta tinha um significado profundo para a utilização do mRNA como terapia. Estes resultados seminais foram publicados em 2005, quinze anos antes da pandemia da COVID-19.
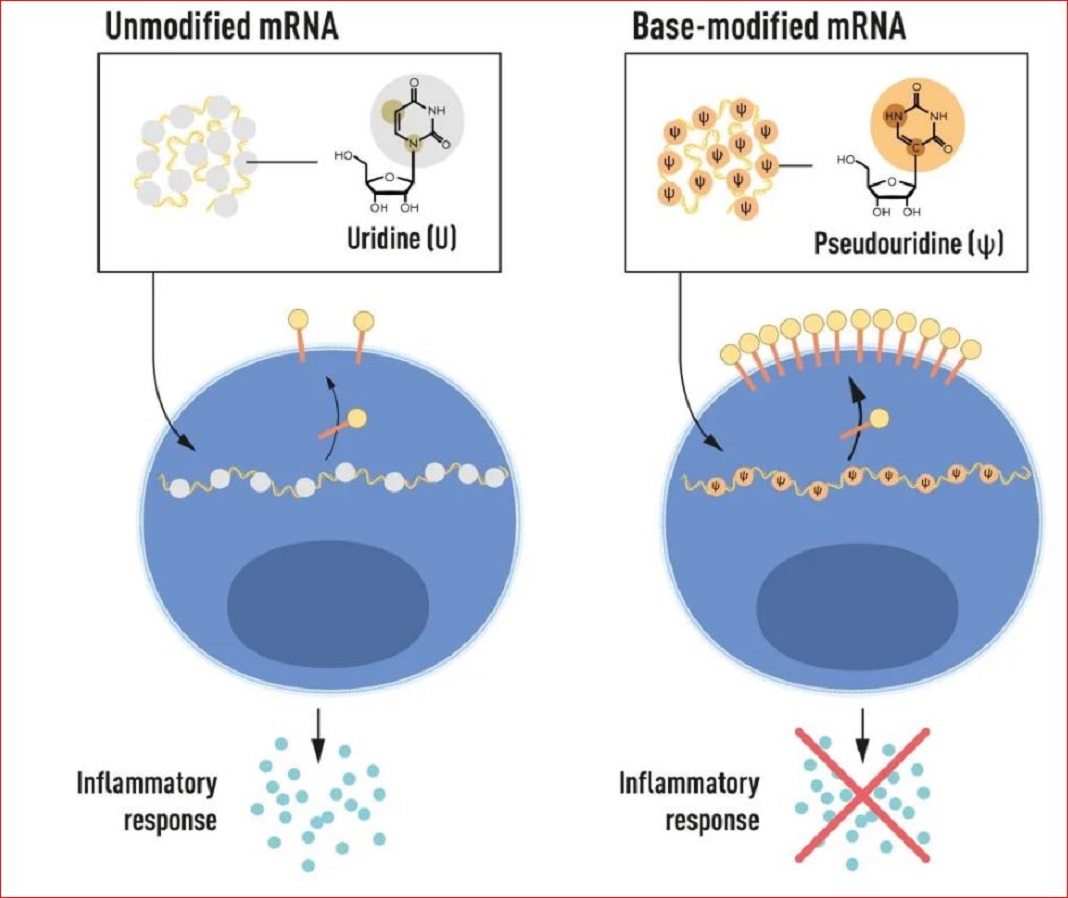
Figura 2. O mRNA contém quatro bases diferentes, abreviadas A, U, G e C. Os ganhadores do Prêmio Nobel descobriram que o mRNA com base modificada pode ser usado para bloquear a ativação de reações inflamatórias (secreção de moléculas sinalizadoras) e aumentar a produção de proteínas quando o mRNA é entregue às células. © Comitê Nobel de Fisiologia ou Medicina. Ilustração: Mattias Karlén
Em estudos adicionais publicados em 2008 e 2010, os dois cientistas mostraram que a entrega de mRNA gerado com modificações de base aumentou acentuadamente a produção de proteínas em comparação com o mRNA não modificado. O efeito foi devido à redução da ativação de uma enzima que regula a produção de proteínas. Através das suas descobertas de que as modificações de base reduziram as respostas inflamatórias e aumentaram a produção de proteínas, Karikó e Weissman eliminaram obstáculos críticos no caminho para as aplicações clínicas do mRNA.
As vacinas de mRNA perceberam o seu potencial
O interesse pela tecnologia de mRNA começou a aumentar e, em 2010, várias empresas trabalhavam no desenvolvimento do método. Foram procuradas vacinas contra o vírus Zika e MERS-CoV; este último está intimamente relacionado ao SARS-CoV-2. Após o início da pandemia de COVID-19, duas vacinas de mRNA com base modificada que codificam a proteína de superfície SARS-CoV-2 foram desenvolvidas em velocidade recorde. Foram relatados efeitos protetores de cerca de 95% e ambas as vacinas foram aprovadas já em dezembro de 2020.
A impressionante flexibilidade e rapidez com que as vacinas mRNA podem ser desenvolvidas abrem caminho à utilização da nova plataforma também para vacinas contra outras doenças infeciosas. No futuro, a tecnologia também poderá ser usada para fornecer proteínas terapêuticas e tratar alguns tipos de cancro.
Várias outras vacinas contra o SARS-CoV-2, baseadas em diferentes metodologias, também foram rapidamente introduzidas e, em conjunto, foram administradas globalmente mais de 13 mil milhões de doses de vacinas contra a COVID-19. As vacinas salvaram milhões de vidas e preveniram doenças graves em muitas mais, permitindo que as sociedades se abrissem e regressassem às condições normais. Através das suas descobertas fundamentais sobre a importância das modificações de bases no mRNA, os laureados com o Nobel deste ano contribuíram criticamente para este desenvolvimento transformador durante uma das maiores crises de saúde do nosso tempo.
Os laureados com Prémio Nobel
Katalin Karikó nasceu em 1955 em Szolnok, Hungria. Ela recebeu o doutorado pela Universidade de Szeged em 1982 e realizou investigação de pós-doutorado na Academia Húngara de Ciências em Szeged até 1985. Em seguida, conduziu investigação de pós-doutorado na Temple University, Filadélfia, e na Universidade de Ciências da Saúde, Bethesda. Em 1989, foi nomeada professora assistente na Universidade da Pensilvânia, onde permaneceu até 2013. Depois disso, tornou-se vice-presidente e posteriormente vice-presidente sénior da BioNTech RNA Pharmaceuticals. Desde 2021, é professora na Universidade de Szeged e professora adjunta na Perelman School of Medicine da Universidade da Pensilvânia.
Drew Weissman nasceu em 1959 em Lexington, Massachusetts, EUA. Ele recebeu o título de doutoramento e pós-doutorado pela Universidade de Boston em 1987. Fez a sua prática clínica no Beth Israel Deaconess Medical Center na Harvard Medical School e fez investigação de pós-doutorado no National Institutes of Health. Em 1997, Weissman estabeleceu seu grupo de investigação na Perelman School of Medicine da Universidade da Pensilvânia. É professor e diretor do Penn Institute for RNA Innovations.