
O cancro mata milhões de pessoas todos os anos e é um dos maiores desafios da humanidade em relação à saúde, indicou a Assembleia do Nobel no Instituto Karolinska.
Ao estimular a capacidade inerente do nosso sistema imunológico de atacar as células tumorais, os laureados com o Nobel, deste ano, estabeleceram um princípio inteiramente novo para a terapia do cancro.
James P. Allison estudou uma proteína já conhecida que funciona como um travão no sistema imunológico. O cientista percebeu o potencial de libertar o travão e, assim, libertar nossas células imunológicas para atacar os tumores, desenvolvendo, neste caso, um novo conceito de abordagem para o tratamento do cancro.
Em paralelo, Tasuku Honjo descobriu uma proteína nas células do sistema imunológico e, após uma cuidadosa exploração da função da proteína, acabou por verificar que também funciona como um travão, mas possuindo um mecanismo de ação diferente. Terapias baseadas nesta descoberta mostraram-se surpreendentemente eficazes na luta contra o cancro.
James P. Allison e Tasuku Honjo mostraram como diferentes estratégias para inibir os travões do sistema imunológico podem ser usadas no tratamento do cancro. As descobertas dos dois cientistas constituem um marco na luta contra o cancro.
A nossa defesa imunológica pode ser envolvida no tratamento do cancro?
O cancro compreende muitas diferentes doenças, todas caracterizadas pela proliferação descontrolada de células anormais com capacidade de disseminação para órgãos e tecidos saudáveis. Há várias abordagens terapêuticas disponíveis para o tratamento do cancro, incluindo a cirurgia, a radiação e outras estratégias, algumas delas também foram anteriormente reconhecidas com prémios Nobel. Como o caso de métodos para tratamento hormonal para o cancro da próstata, por Huggins, em 1966, por quimioterapia, por Elion e Hitchins, em 1988, e o transplante de medula óssea para o tratamento da leucemia, por Thomas, em 1990.
No entanto, o cancro avançado permanece difícil de tratar, pelo que são necessárias novas estratégias terapêuticas.
No final do século XIX e início do século XX, surgiu o conceito de que a ativação do sistema imunológico poderia ser uma estratégia para atacar as células tumorais. Neste sentido foram feitas várias tentativas utilizando bactérias injetadas nos pacientes para ativar o sistema imunológico. Os esforços feitos só tiveram efeitos modestos, no entanto, mas uma variante dessa estratégia é usada atualmente no tratamento do cancro da bexiga.
Dada a necessidade de haver mais conhecimento muitos cientistas envolveram-se numa intensa investigação básica e descobriram mecanismos fundamentais que regulam a imunidade e também mostraram como o sistema imune pode reconhecer células cancerígenas. Mas apesar de um notável progresso científico, as tentativas de desenvolver novas estratégias generalizáveis contra o cancro mostraram-se difíceis de atingir.
Aceleradores e travões no nosso sistema imunológico
A propriedade fundamental do nosso sistema imunológico é a capacidade de discriminar o que é “próprio da pessoa” e o que “não-próprio da pessoa”, de modo que bactérias, vírus e outros perigos invasores possam ser atacados e eliminados.
As células T, que são um tipo de glóbulo branco, são as principais intervenientes nesta defesa. As células T mostraram ter recetores que se ligam a estruturas reconhecidas como “não-próprias da pessoa” e tais interações levam o sistema imunológico a envolver-se na defesa. Mas também são necessárias proteínas adicionais, como aceleradores de células T, para desencadear uma resposta imune completa.
Muitos cientistas contribuíram para essa importante investigação básica e identificaram outras proteínas que funcionam como travões nas células T, inibindo a ativação imunológica. Esse equilíbrio intrincado entre aceleradores e travões é essencial para um controlo rígido do sistema de modo a assegurar que o sistema imunológico esteja suficientemente envolvido no ataque contra microrganismos estranhos, evitando a ativação excessiva que pode levar a destruição autoimune de células e tecidos saudáveis.
Um novo princípio para terapia imunológica
Durante a década de 1990, num Laboratório da Universidade da Califórnia, em Berkeley, James P. Allison estudou a proteína CTLA-4 de células-T, e verificou, tal como vários outros cientistas, que a CTLA-4 funciona como um travão nas células T.
Outras equipas de pesquisa exploraram o mecanismo como alvo para o tratamento de doenças autoimunes. James P. Allison, no entanto, teve uma ideia totalmente diferente, pois tinha desenvolvido um anticorpo que poderia ligar-se à CTLA-4 e bloquear sua função.
O cientista começou a investigar se o bloqueio do CTLA-4 poderia desacoplar o travão das células T e desencadear o sistema imunológico no ataque às células cancerígenas. James P. Allison e colaboradores realizaram uma primeira experiencia no final de 1994 e, com entusiasmo, repetiram as experiencias durante as férias de Natal. Os resultados foram espetaculares. Ratos com cancro foram curados pelo tratamento com os anticorpos que inibem o travão e destroem a atividade ‘antitumor’ da célula T.
Apesar do pouco interesse manifestado pela indústria farmacêutica, James P. Allison continuou os seus intensos esforços para desenvolver uma terapia para humanos, e logo surgiram de vários grupos resultados promissores.
Em 2010 um importante estudo clínico mostrou efeitos notáveis em pacientes com melanoma avançado, um tipo de cancro da pele. Em vários pacientes, os sinais de cancro remanescente desapareceram. Tais resultados nunca tinham sido vistos antes neste grupo de pacientes.
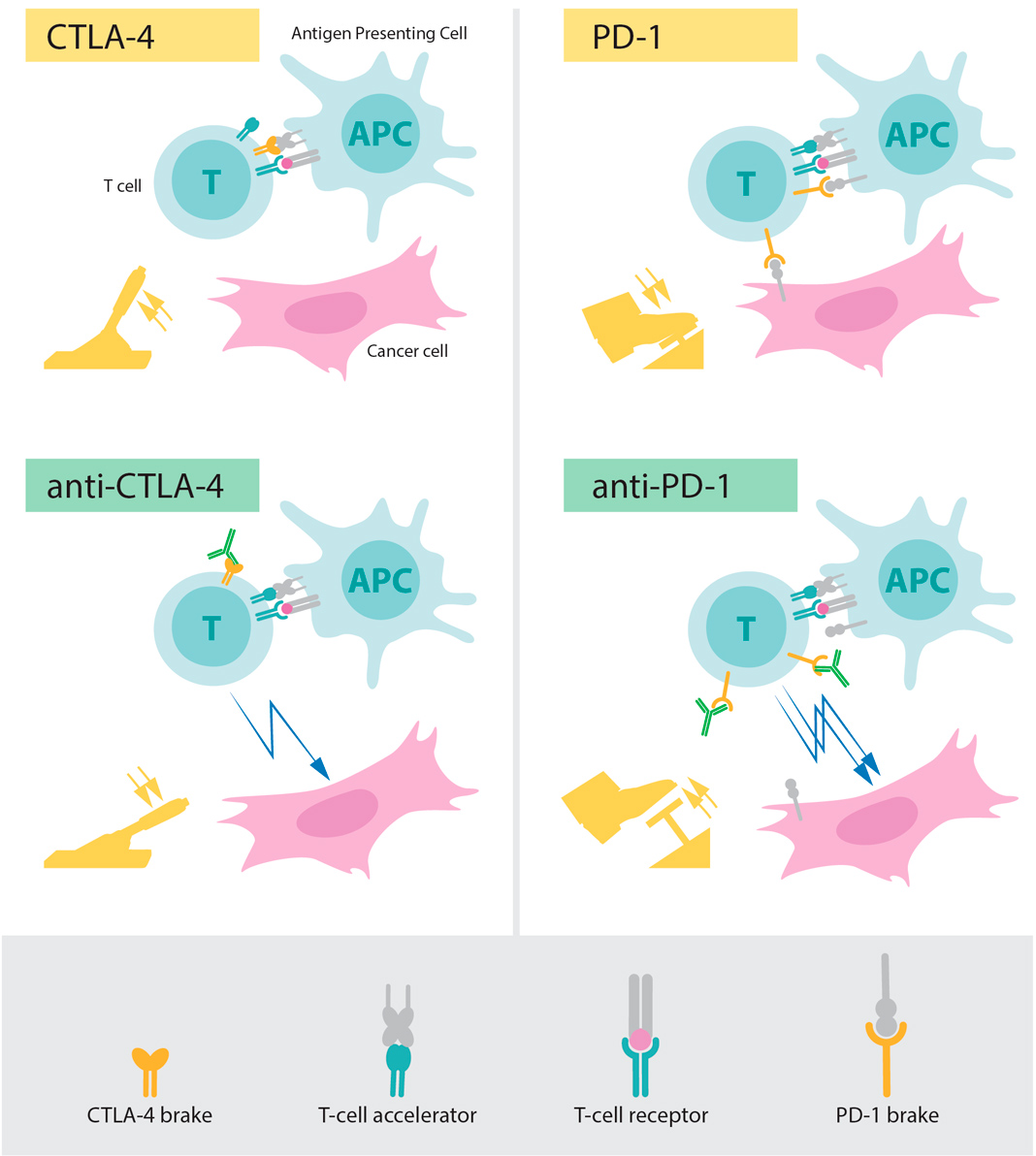
Superior direito: PD-1 é outro freio de células T que inibe a ativação de células T. Inferior direito: Os anticorpos contra o PD-1 inibem a função do freio, levando à ativação das células T e ao ataque altamente eficiente às células cancerígenas. © Instituto Karolinska
Descoberta do PD-1 e sua importância para a terapia do cancro
Em 1992, alguns anos antes da descoberta de James P. Allison, Tasuku Honjo tinha descoberto a PD-1, outra proteína que é expressa na superfície das células-T. O cientista explorou meticulosamente a função dessa proteína, numa série de experiencias que realizou ao longo de vários anos no Laboratório da Universidade de Kyoto.
Os resultados das experiencias de Tasuku Honjo mostraram que a PD-1, é similar à CTLA-4, funcionando como um travão das células T, mas operando através de um mecanismo diferente. Em experiencias com animais, o cientista mostrou que o bloqueio da PD-1 também pode ser uma estratégia promissora na luta contra o cancro, abrindo assim caminho para a utilização da PD-1 como alvo no tratamento de pacientes.
Foi dado desenvolvimento clínico e, em 2012, um importante estudo demonstrou clara eficácia no tratamento de pacientes com diferentes tipos de cancro. Os resultados foram dramáticos, levando à remissão a longo prazo e a uma possível cura em vários pacientes com cancro metastático, uma condição que antes era considerada como intratável.
Terapia de checkpoint imunológico para o cancro de hoje e no futuro
Após os estudos iniciais que mostravam os efeitos do bloqueio da CTLA-4 e da PD-1, deu-se um grande desenvolvimento clínico. Sabemos agora que o tratamento, muitas vezes referido como “terapia de checkpoint imunológico”, mudou fundamentalmente o resultado para certos grupos de pacientes com cancro avançado.
Tal como em outras terapias contra o cancro são observados efeitos colaterais adversos, que podem ser graves e até fatais. Estes efeitos são causados por uma resposta imune hiperativa que leva a reações autoimunes, mas geralmente são geríveis. A investigação contínua intensa está focada para esclarecer os mecanismos de ação, com o objetivo de melhorar as terapias e reduzir os efeitos colaterais.
Das duas estratégias de tratamento, a terapia com checkpoint contra PD-1 tem-se mostrado mais eficaz e os resultados positivos estão a ser observados em vários tipos de cancro, incluindo no cancro do pulmão, cancro renal, linfoma e melanoma. Havendo novos estudos clínicos que indicam que a terapia combinada, visando a CTLA-4 e a PD-1, pode ser ainda mais eficaz, como já foi demonstrado em pacientes com melanoma.
Assim, James P. Allison e Tasuku Honjo inspiraram esforços para combinar diferentes estratégias para liberar os travões do sistema imunológico, com o objetivo de eliminar as células tumorais de forma ainda mais eficiente. Um grande número de testes terapêuticos com checkpoint está atualmente em andamento contra a maioria dos tipos de cancro, e novas proteínas de checkpoint estão a ser testadas como alvos.
Durante mais de 100 anos, os cientistas tentaram envolver o sistema imunológico na luta contra o cancro, mas só a partir das descobertas dos dois cientistas, agora laureados com o prémio Nobel, houve o desenvolvimento clinico que conduziu a terapia que revolucionou o tratamento do cancro e mudou fundamentalmente a maneira como vemos a forma de o cancro poder ser gerido.















