Os cientistas Mineko Kengaku, Tatsuya Murakami e outros cientistas do Institute for Integrated Cell-Material Sciences (iCeMS), da Universidade de Kyoto, desenvolveram um novo método que modifica a superfície dos nanobastões (em inglês, nanorods) de ouro, tornando-os mais eficientes no transporte de genes que matam as células cancerígenas.
O método envolve o revestimento dos nanobastões de ouro, que produzem calor quando expostos a um laser próximo de infravermelho, com o oleato de lipídios e DOTAP. Os lipídios aumentam a capacidade dos nanobastões de interagir e penetrar nas células.
A equipa de cientistas também desenvolveu um portador de genes, conhecido como um vetor plasmídico, que inclui uma ‘proteína de choque térmico’ que é ativada por calor.
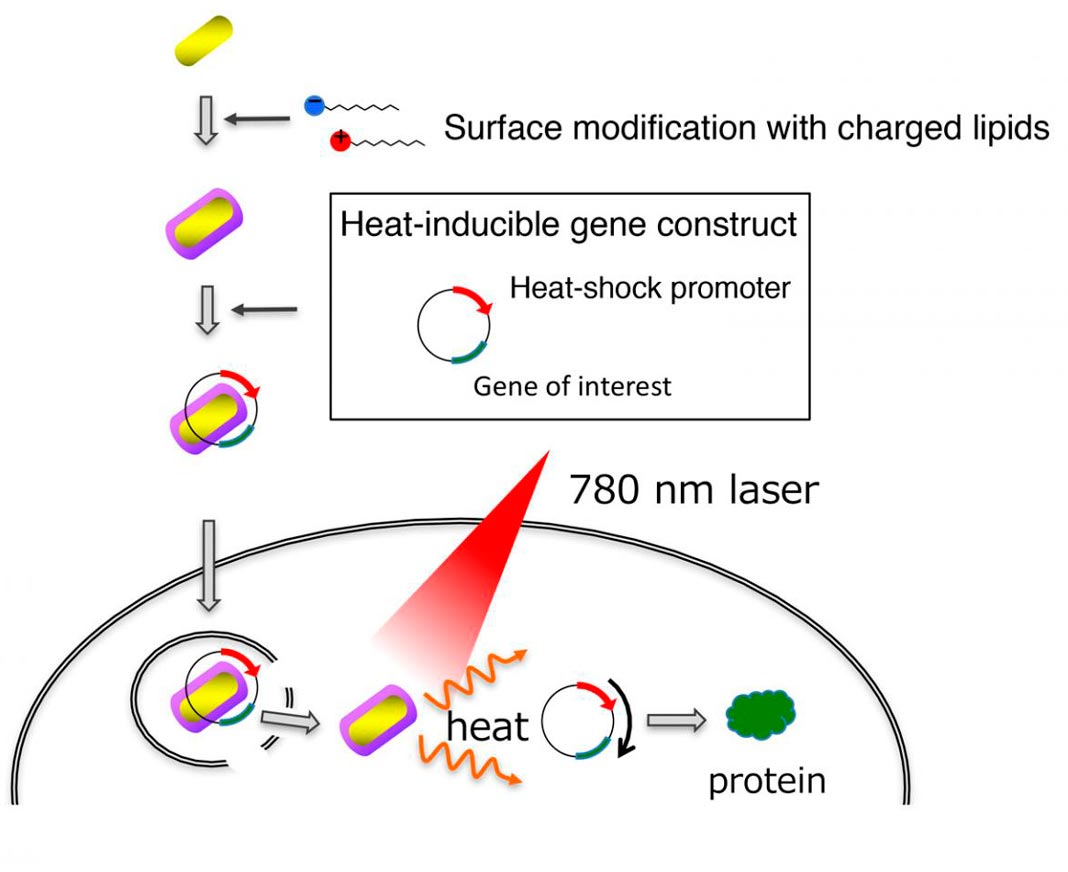
O novo método e, em primeiro lugar, o vetor foi ligado ao gene da ‘proteína fluorescente verde melhorada’ (EGFP, do inglês) e depois transferido para células de mamífero pelos nanobastões de ouro revestidos de lipídios.
Com os nanobastões nas células, estas foram expostas a um laser próximo do infravermelho durante dez segundos, os nanobastões de ouro aqueceram, e o calor ativou o gene EGFP. As células que não eram o alvo apresentaram pouca ou nenhuma expressão de EGFP, ou seja, o gene não foi ativado.
Uma proteína chamada TRAIL foi então adicionada ao vetor plasmídico. A TRAIL induz a morte celular em linhas celulares de cancro. A iluminação infravermelha de células transfectadas por TRAIL levou a uma alta taxa de mortalidade celular nas células cancerígenas circundantes.
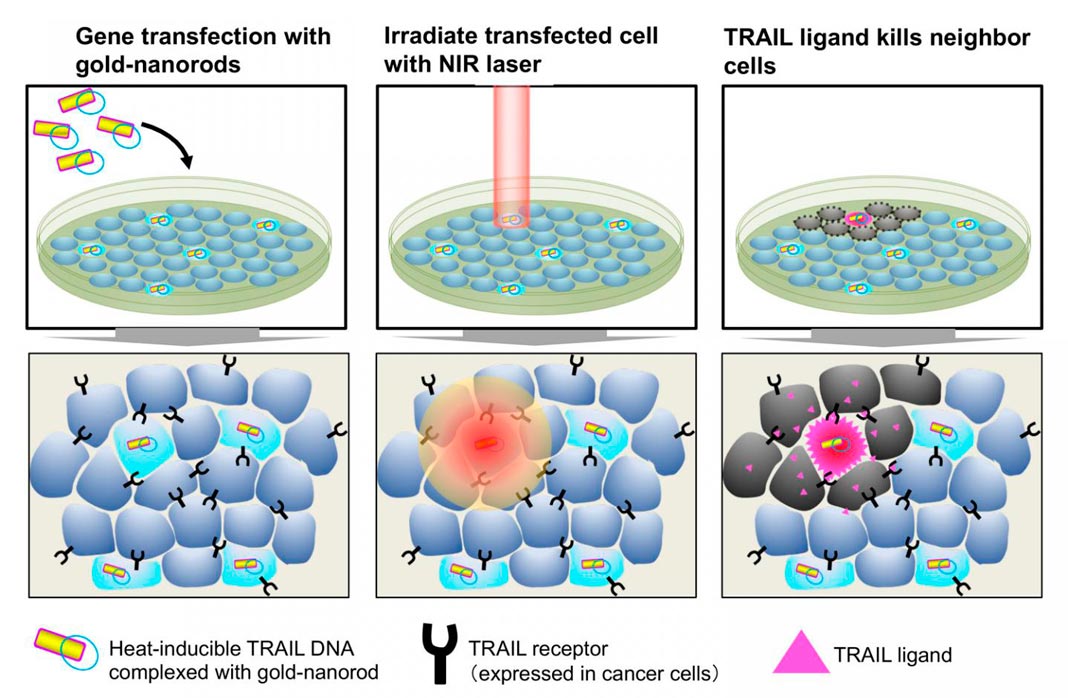
Os cientistas mostraram, desta forma, que os nanobastões de ouro revestidos com lipídios podem ajudar no desenvolvimento de terapias moleculares de cancro mais eficazes.
No estudo já publicado na revista ‘Scientific Reports’, os cientistas concluem que o novo método a que chegaram “oferece uma oportunidade única para a expressão do transgene induzido por luz, em células de mamíferos por um laser de infravermelho próximo, com uma fototoxicidade mínima”.
















